Rigenerazione ossea: superare gli ostacoli biologici
Cenni di biologia della rigenerazione ossea
STEFANO PAGNUTTI
in Rinaldi, M. – Mottola, A. (a cura di):
Superamento degli ostacoli anatomici in chirurgia implantare.
Implantologia computer-guidata – Innesti ossei – ©ELSEVIER 2009
pp. 34-45
Introduzione
L’ esecuzione di innesti ossei, siano essi autologhi o eseguiti con biomateriali, e le tecniche di rigenerazione ossea guidata (GBR, Guided Bone Regeneration) con membrane in grado di esercitare un effetto tenda si fondano tutti sul presupposto di essere in grado di innescare nella sede di intervento processi di rigenerazione tessutale in grado di ricreare una porzione di tessuto perduta, ripristinando così sia l’ anatomia sia la funzione del sito osseo.
I processi di rigenerazione, una volta attivati, avvengono attraverso una successione di eventi biochimici, cellulari e tessutali definita a priori dell’ atto chirurgico dalle stesse caratteristiche biologiche del tessuto osseo.
La chirurgia, quindi, non può alterare questa successione di eventi né modificare – in senso positivo – la velocità con cui essi avvengono. Può invece, e purtroppo, creare condizioni sfavorevoli alla rigenerazione ossea fino a essere causa del fallimento dell’ intervento. Risulta quindi necessario comprendere quali siano gli eventi fondamentali della rigenerazione ossea e quali siano le precauzioni da mettere in atto durante l’atto chirurgico per evitare di impedirne il normale svolgimento.
Triade tessutale
Da un punto di vista strettamente biologico, affinché vi possa essere rigenerazione tessutale è necessario che siano presenti tre elementi, componenti la cosiddetta triade dell’ ingegneria tessutale (Fig. 2.9): uno scaffold, delle cellule e dei fattori di crescita.
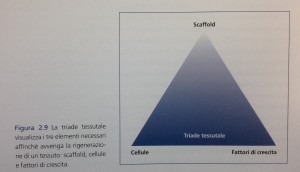 Lo scaffold (ovvero, sostegno, impalcatura) consiste nel materiale (autologo o altro) che è innestato per ripristinare il difetto osseo. La sua funzione è creare una struttura spaziale in grado di ospitare e sostenere meccanicamente gli elementi cellulari e tessutali (per esempio, i vasi sanguigni) che andranno a colonizzare il volume innestato e lo rigenereranno. Questa funzione è cruciale in quanto la diffusione di cellule e vasi è impossibile in uno spazio vuoto.
Lo scaffold (ovvero, sostegno, impalcatura) consiste nel materiale (autologo o altro) che è innestato per ripristinare il difetto osseo. La sua funzione è creare una struttura spaziale in grado di ospitare e sostenere meccanicamente gli elementi cellulari e tessutali (per esempio, i vasi sanguigni) che andranno a colonizzare il volume innestato e lo rigenereranno. Questa funzione è cruciale in quanto la diffusione di cellule e vasi è impossibile in uno spazio vuoto.
L’ innesto svolge così un primo importante effetto di osteoconduzione, ovvero funge da spazio fisico colonizzabile da cellule e vasi cui da sostegno meccanico
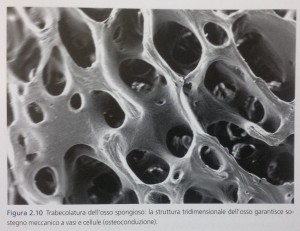 (Fig. 2.10). L’effetto osteoconduttivo non prevede un’ interazione di tipo biochimico tra l’ innesto e il tessuto ricevente, ma dipende esclusivamente dai parametri di tipo fisico che caratterizzano il biomateriale: principalmente le sue caratteristiche morfologiche e di superficie (come la dimensione dei pori, la rugosità della superficie e altre). Nel caso degli innesti di osso autologo, questi parametri – trattandosi dello stesso tessuto oggetto di rigenerazione – sono chiaramente già ottimali.
(Fig. 2.10). L’effetto osteoconduttivo non prevede un’ interazione di tipo biochimico tra l’ innesto e il tessuto ricevente, ma dipende esclusivamente dai parametri di tipo fisico che caratterizzano il biomateriale: principalmente le sue caratteristiche morfologiche e di superficie (come la dimensione dei pori, la rugosità della superficie e altre). Nel caso degli innesti di osso autologo, questi parametri – trattandosi dello stesso tessuto oggetto di rigenerazione – sono chiaramente già ottimali.
Gli elementi cellulari sono i responsabili diretti dell’ evento rigenerativo: nel tessuto osseo saranno più precisamente gli osteoblasti, in grado di deporre nuova matrice ossea, parte della quale sarà successivamente mineralizzata.
Nel caso particolare degli innesti di osso autologo, una parte degli osteoblasti, compatibilmente con il grado di necrosi dell’ innesto dovuto alla durata dell’ ischemia generata dall’ atto del prelievo, sarà anche portata in sede di innesto con il tessuto autologo stesso. In questo caso particolare il materiale innestato, oltre a possedere l’effetto osteoconduttivo sopracitato, esercita, almeno in parte, anche un effetto osteogenetico, cioè un’azione diretta di generazione di tessuto osseo grazie agli elementi cellulari ancora vitali che esso possiede al suo interno.
Il terzo elemento necessario affinché vi possa essere rigenerazione ossea sono i fattori di crescita. Si tratta di un numero molto elevato di segnali chimici, la maggior parte di natura proteica e peptidica, che innescano e modulano i diversi prefissi che sottintendono alla rigenerazione ossea. La loro presenza e necessaria poiché la rigenerazione nel suo complesso è un evento particolare e limitato nel tempo e nello spazio che in condizioni fisiologiche non avviene. In altri termini, si tratta di un succedersi di eventi che deve essere innescato, regolato nel suo svolgersi e terminato una volta che la rigenerazione ha avuto luogo.
Tipicamente l’azione dei fattori di crescita si esercita attraverso variazioni significative della loro concentrazione locale e non solo in relazione alla loro assenza o presenza. Inoltre, in un dato momento, l’ effetto finale osservato è determinato
spesso dai rapporti delle reciproche concentrazioni dei diversi fattori in gioco. Anche i fattori di crescita, come gli elementi cellulari, raggiungono il sito innestato provenendo dal tessuto vitale del paziente: possono essere portati dal circolo ematico e/o sintetizzati e secreti da elementi cellulari (anch’essi portati dal circolo ematico, o presenti a livello del letto osseo ricevente).
I fattori di crescita, e in generale le molecole segnale la cui concentrazione varia durante l’ evento rigenerativo, sono responsabili dell’ effetto di osteoinduzione, cioè l’ attivazione per via biochimica degli eventi cellulari e tessutali che porteranno alla rigenerazione del tessuto osseo e quindi a colmare il difetto.
Nel caso degli innesti di osso autologo una piccola parte di questi fattori è già presente nel’ innesto stesso, anche se la variazione di concentrazione in grado di “accendere” gli eventi rigenerativi è dovuta all’ apporto locale del tessuto ricevente.
L’ azione dei fattori di crescita sulle cellule bersaglio si esplica non solo attivando, in seguito al legame con un specifico recettore, specifici eventi intracellulari (accensione o spegnimento di geni, up- o down-regulation di specifiche vie biochimiche ecc.), ma anche richiamando gli stessi elementi cellulari nel sito da rigenerare per chemiotassi.
Eventi della rigenerazione ossea
Verranno ora esaminati più in dettaglio gli eventi che portano alla rigenerazione ossea.
Angiogenesi
Il primo evento che si osserva negli interventi di rigenerazione ossea è l’ angiogenesi (Fig. 2.1 1). Consiste nella permeazione del sito innestato da parte di una fitta rete di vasi capillari. La creazione di questa rete permetterà che il sito sia colonizzato dagli elementi cellulari che sono portati in situ, appunto, attraverso il circolo ematico.
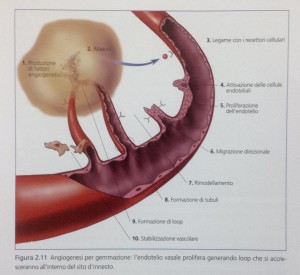 La generazione di nuovi vasi sanguigni avviene per gemmazione da parte di vasi già esistenti. Sotto fazione di un insieme di fattori di crescita, le cellule dell’ endotelio vasale sono stimolate a dividersi e a organizzare dei loop che, accrescendosi soprattutto in lunghezza, invaderanno il sito innestato.
La generazione di nuovi vasi sanguigni avviene per gemmazione da parte di vasi già esistenti. Sotto fazione di un insieme di fattori di crescita, le cellule dell’ endotelio vasale sono stimolate a dividersi e a organizzare dei loop che, accrescendosi soprattutto in lunghezza, invaderanno il sito innestato.
I fattori di crescita coinvolti in questo processo sono molteplici. Tra i più noti – anche per gli studi sull’ angiogenesi tumorale – è il fattore VEGF (Vascular Ebdothelial Growrh Factor, fattore di crescita dell’ endotelio vasale), che esiste in almeno sei diverse forme. Altrettanto Importante è una serie di altri fattori tra cui il PDGF (Platelet-Derived Growth Factor, fattore di crescita derivato dalle piastrine), che deriva dalla degranulazione piastrinica, uno degli eventi chiave per la formazione del coagulo sanguigno, e altri quali diverse forme dell’ FGF (Fibroblast Growth Factor, fattore di crescita dei fibroblasti) e membri della famiglia dei TGF-β (Transforming Growth Factor beta, fattore beta di crescita tessutale).
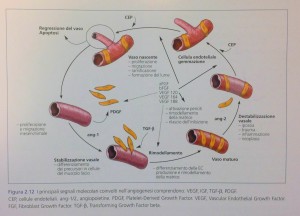 Risulta interessante notare come l’ angiogenesi sia di fatto innescata da una cascata di segnali (Fig 2.12) di natura infiammatoria. ll significato adattativo, in senso evolutivo, di questo fenomeno è chiaro qualora si pensi che gli eventi di tipo rigenerativo e riparativo devono essere indotti quando l’organismo subisce insulti traumatici.
Risulta interessante notare come l’ angiogenesi sia di fatto innescata da una cascata di segnali (Fig 2.12) di natura infiammatoria. ll significato adattativo, in senso evolutivo, di questo fenomeno è chiaro qualora si pensi che gli eventi di tipo rigenerativo e riparativo devono essere indotti quando l’organismo subisce insulti traumatici.
In questo senso, la preparazione del letto ricevente l’ innesto e la parziale decorticalizzazione sia essa eseguita con scraper o fresa a palla o altro, non solo favorisce l’apporto ematico (e soprattutto l’arrivo della rete capillare), ma anche realizza un evento infiammatorio – localizzato – in grado di innescare l’ aumento di concentrazione dei fattori proangiogenetici.
Gli eventi angiogenetici avvengono in un lasso di tempo alquanto ridotto (si suppone entro 96 ore dall’ innesto) e giocano un ruolo cruciale nel successo dell’ intero atto rigeneraitivo. Un’ angiogenesi parziale conduce infatti a una rigenerazione volumetricamente direttiva. Il materiale innestato non colonizzato dalla rete Vasale andrà incontro a riassorbimento (se riassorbibile, come nel caso dell’ osso autologo) o, se non riassorbibile, a incapsulamento in tessuto fibroso o, nella migliore delle ipotesi, a osteointegrazione.
Morfogenesi
Dopo che il sito innestato è stato colonizzato dai vasi capillari, le modificazioni della permeabilità delle giunzioni cellulari a livello dell’ endotelio vasale indotte da specifici fattori di crescita permettono la fuoriuscita dagli stessi vasi di cellule mesenchimali quiescenti, sempre presenti nel circolo ematico. Tali cellule consistono in elementi ancora non completamente differenziati che conservano la proprietà (multipotenza) di differenziarsi in diversi tipi cellulari, quali fibroblasti o osteoblasti. Nel contesto della rigenerazione ossea, specifici segnali molecolari (in parte comuni con quelli proangiogenetici), tra i quali particolare importanza rivestono le BMP (Bone Morphogenetic Proteins, proteine morfogenetiche dell’ osso), ne inducono il differenziamento in osteoblasti, cioè cellule attive. Questo processo di differenziamento è noto come morfogenesi.
Da un punto di vista molecolare e interessante notare come l’azione di questi dattori di crescita riehieda, per potersi esplicare, la presenza di specifiche molecole della matrice extracellulare. Nel caso specifico del tessuto osseo è necessario sia presente il collagene osseo di tipo I (presente solo in questo tessuto), che agisce come coattivatore specifico dei segnali pro-osteogenetici. La sua presenza agisce come u na sorta di “segnale di conferma” dell’ evento morfogenetico assicurando che il differenziamento delle cellule mesenchimali in osteoblasti avvenga solo là dove essi devono effettivamente esercitare la loro funzione.
Osteogenesi
La cellula mesenchimale, differenziandosi in osteoblasto attivo, subisce importanti modificazioni ultrastrutturali, chiaramente visibili in microscopia elettronica a trasmissione. La più evidente è l’ occupazione di una frazione significativa del volume citoplasmatico da parte del reticolo endoplasmatico rugoso, sede della sintesi delle proteine che dovranno essere escrete.
L’ osteoblasto attivo (Fig. 2.13), infatti, sintetizza e secerne la matrice extracellulare ossea. Si tratta di una miscela composta di differenti proteine e proteoglicani; il secreto più abbondante consiste tuttavia di molecole di tropocollagene, che all’esterno della cellula si organizzeranno in microfibrille, fibrille e, infine, fibre di collagene osseo.
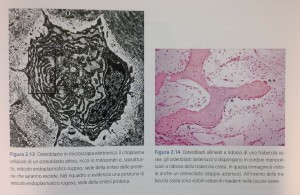 Da un punto di vista biochimico, l’ osteoblasto attivo si riconosce anche per l’ espressione e l’ attività dell’ enzima fosfatasi alcalina, una glicoproteina tetramerica di superficie. Questa proteina è presente in diverse isoforme che potrebbero anche riflettere differenti stadi della maturazione della cellula a partire dal suo
Da un punto di vista biochimico, l’ osteoblasto attivo si riconosce anche per l’ espressione e l’ attività dell’ enzima fosfatasi alcalina, una glicoproteina tetramerica di superficie. Questa proteina è presente in diverse isoforme che potrebbero anche riflettere differenti stadi della maturazione della cellula a partire dal suo
precursore. Sebbene si ritenga che essa giochi un ruolo chiave nel processo di mineralizzazione ossea, la sua funzione biologica non è ancora esattamente compresa.
Da un punto di vista istologico, gli osteoblasti si dispongono in cordoni monocellulari contornanti la porzione di trabecola ossea in via di accrescimento (Fig.2.14). Le cellule sono tra loro connesse da gap junction che, mettendo in comunicazione i citoplasmi cellulari, realizzano delle vie preferenziali per la coordinazione dell’ attività metabolica dell’ intero gruppo di cellule.
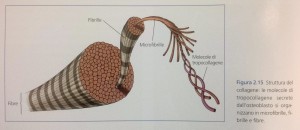
Le fibre di collagene prodotte dalla cellula osteoblastica, riconoscibili per la tipica struttura trasversale spaziata di circa 70 nm dovuta alla disposizione reglare al loro interno delle molecole di tropocollagene, sono in seguito mineralizzate per l’apposizione su di esse di un sale complesso di calcio e fosforo (apatite ossea).
Il meccanismo di mineralizzazione della libra di collagene e ancora oggetto di studio, ma si suppone che esso avvenga anche grazie al fatto che la struttura regolare del collagene (che presenta, appunto, delle zone di giunzione tra molecole di tropocollagene spazialmente distribuite con regolarità) possa presentare dei centri di nucleazione per la formazione dei cristalli di minerale, facilitandone la deposizione (questo processo fisico prende il nome di epitassia).
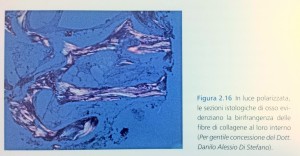
 La regolarità strutturale delle fibre di collagene è anche responsabile della loro
La regolarità strutturale delle fibre di collagene è anche responsabile della loro
birifrangenza, un fenomeno ottico sfruttato in microscopia per l’analisi delle sezioni istologiche poiché, illuminate con luce polarizzata, esse rifrangono e diventano particolarmente luminose, permettendo cosi l’ individuazione delle zone di
tessuto di nuova formazione (Fig. 2.15).
Il collagene osseo, oltre a svolgere un’ azione prorigenerativa dovuta alla sua peculiare struttura regolare è in grado anche di promuovere specifici eventi cellulari.
Tra questi, per brevità, viene citata solo l’ adesione cellulare. Sia gli osteoblasti sia gli osteoclasti sono infatti in grado di aderire al collagene osseo grazie a un preciso riconoscimento di sequenze aminoacidiche specifiche della catena del tropocollagene (come la sequenza RGD costituita dagli aminoacidi arginina, glicina, aspartato) da parte di proteine esposte sulla superficie cellulare quali le integrine.
Nel corso del processo di formazione del tessuto osseo alcuni osteoblasti restano inglobati nella trabecola ossea in via di formazione, divenendo osteociti (si veda Fig. 2.14). Gli osteociti sono tra loro interconnessi attraverso una fitta rete di prolungamenti citoplasmatici che passano attraverso sottili canaliculi. La funzione degli osteociti è con ogni probabilità quella di realizzare un network specializzato di cellule in grado di agire da sensori delle deformazioni meccaniche cui è soggetto l’ osso, attivandone il rimodellamento tramite la secrezione di specifici segnali proteici: essi però potrebbero svolgere anche altre funzioni, e questo argomento oggi oggetto di studi approfonditi.
Assorbimento osteoclastico
Nel sito di innesto successivamente sarà possibile osservare un’ulteriore linea cellulare, gli osteoclasti, che si differenziano a partire da elementi cellulari precursori provenienti dal circolo ematico, appartenenti alla linea monocito-macrofagica. Si tratta di cellule deputate alla degradazione della matrice minerale ossea.
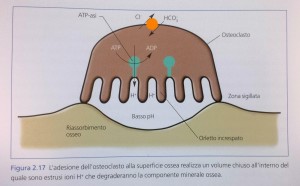
 Da un punto di vista morfologico l’ osteoclasto è facilmente riconoscibile poiché si tratta di una cellula multinucleata, derivante dalla fusione di più elementi mononucleati. La sua attività di degradazione della matrice minerale prevede prima di tutto la sua adesione al minerale. Di seguito, esso forma uno stretto sigillo con
Da un punto di vista morfologico l’ osteoclasto è facilmente riconoscibile poiché si tratta di una cellula multinucleata, derivante dalla fusione di più elementi mononucleati. La sua attività di degradazione della matrice minerale prevede prima di tutto la sua adesione al minerale. Di seguito, esso forma uno stretto sigillo con
la porzione minerale stessa, isolando una porzione di superficie al di sotto della membrana citoplasmatica e realizzando un volume chiuso. All’ interno di questo volume la cellula secerne, attraverso pompe protoniche e canali ionici presenti sulla sua membrana cellulare, ioni idrogeno H+ che scioglieranno parzialmente
l’ apatite ossea mettendo a nudo le fibre di collagene su cui essa era deposta.
La creazione di questo sigillo conferisce all’ osteoclasto, nella sua porzione a contatto con la parte minerale, il tipico aspetto a orletto increspato (ruffled border) (Fig. 2.1 7).
Da un punto di vista ultrastrutturale la creazione di questo sigillo corrisponde a precise modificazioni del citoscheletro che permettono l’adesione della membrana alla sottostante porzione minerale. Queste modificazioni ultrastrutturali portano alla formazione di anelli di filamenti di actina (actin ring) chiaramente visibili in microscopia a immunofluorescenza e caratteristici dell’attività di questo tipo cellulare.
 Da un punto di vista biochimico l’ osteoclasto si distingue per l’espressione e l’attività di numerosi marker, tra cui si ricorda l’ enzima lisosomiale fosfatasi acida tartrato resistente (TRAP, Tartrate-Resistant Acid Phosphatase) che potrebbe svolgere la funzione di regolatore dell’ attività di altre proteine della matrice extracellulare coinvolte nel metabolismo osseo, quali le sialoproteine ossee e l’ osteopontina, modulandone il grado di defosforilazione. Queste proteine costituiscono alcuni dei substrati principali, insieme al collagene, dell’ adesione osteoclastica, e la loro fosforilazione/defosforilazione potrebbe essere connessa al movimento osteoclastico.
Da un punto di vista biochimico l’ osteoclasto si distingue per l’espressione e l’attività di numerosi marker, tra cui si ricorda l’ enzima lisosomiale fosfatasi acida tartrato resistente (TRAP, Tartrate-Resistant Acid Phosphatase) che potrebbe svolgere la funzione di regolatore dell’ attività di altre proteine della matrice extracellulare coinvolte nel metabolismo osseo, quali le sialoproteine ossee e l’ osteopontina, modulandone il grado di defosforilazione. Queste proteine costituiscono alcuni dei substrati principali, insieme al collagene, dell’ adesione osteoclastica, e la loro fosforilazione/defosforilazione potrebbe essere connessa al movimento osteoclastico.
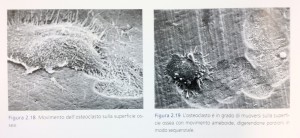 Gli osteoclasti, infatti, migrano con movimento ameboide sulla superficie minerale realizzando delle vere e proprie tracce o lacune di riassorbimento (resorption trail), che si possono evidenziare, per esempio, in microscopia elettronica a scansione (Figg. 2.18, 2.19). Il processo di distacco, migrazione e adesione potrebbe essere modulato proprio dal ciclo di fosforilazione-defosforilazione delle proteine
Gli osteoclasti, infatti, migrano con movimento ameboide sulla superficie minerale realizzando delle vere e proprie tracce o lacune di riassorbimento (resorption trail), che si possono evidenziare, per esempio, in microscopia elettronica a scansione (Figg. 2.18, 2.19). Il processo di distacco, migrazione e adesione potrebbe essere modulato proprio dal ciclo di fosforilazione-defosforilazione delle proteine
della matrice extracellulare sopra citate.
Rimodellamento osseo
La presenza degli osteoclasti, congiuntamente all’ azione degli osteoblasti, rende possibile il rimodellamento osseo, quel meccanismo per cui la parte minerale del tessuto osseo risulta in continuo rimaneggiamento per assorbimento e rideposizione. Questo continuo turnover risponde a una duplice esigenza fisiologica: da un lato, permette che le trabecole ossee si organizzino spazialmente e strutturalmente per rispondere nella maniera migliore alle forze di carico statico e dinamico che esse devono sostenere; dall’ altro, la deposizione/demolizione continua della parte minerale permette un fine controllo dei livelli ematici dello ione calcio, che devono permanere entro range abbastanza ristretti.
L’azione osteoclastica è per questo regolata anche dal livello di diversi ormoni, quali l’ ormone paratiroideo, la calcitonina e altri. Squilibri endocrini possono quindi condurre ad alterazioni anche patologiche del metabolismo osseo (per esempio, losteoporosi).
L’attività congiunta degli osteoclasti e degli osteoblasti realizza un importante risultato: se il materiale innestato è riconosciuto e degradato dagli osteoclasti (Come nel caso di osso autologo) allora esso sarà fisiologicamente sostituito con il tessuto osseo vitale del paziente.
ln alternativa, come nel caso di diversi materiali da innesto, si potranno verificare due situazioni.
Nella prima, il materiale sarà degradato attraverso meccanismi differenti (per esempio, idrolisi), che possiedono una cinetica in genere non allineata a quella fisiologica di rigenerazione e rimodellamento. In questo caso, tipicamente, parte del materiale è degradata prima di essere sostituita, e la rigenerazione è volumetricamente difettiva.
Nella seconda, il materiale non è demolito attraverso altri meccanismi ed è scarsamente o per nulla degradabile per via osteoclastica. In questo caso, si ha per un tempo lunghissimo la permanenza del materiale innestato all’ interno di zone di tessuto osseo neoformato, con nessuna conseguenza se l’intervento è eseguito ai
fini della ricostruzione di un profilo estetico, ma con possibilità di un deficit funzionale (minore resistenza alle forze di carico) se il sito è rigenerato ai fini dell’inserimento di impianti osteointegrati.
Creeping substitution
Nel caso di innesti di osso corticale di origine autologa o omologa il meccanismo che porta alla rigenerazione ossea è un meccanismo che, piuttosto che avvenire per apposizione su di essi di nuovo materiale osseo, si sviluppa fin dall’inizio attraverso un meccanismo specifico di rimodellamento sostitutivo denominato creeping substitution (sostituzione “strisciante”). La rivascolarizzazione del tessuto corticale da parte dei vasi provenienti dal letto ricevente e dalla copertura periostale sarà particolarmente lenta, in quanto – data l’ elevata densità della componente corticale – gli unici punti d’ ingresso per la nuova rete capillare sono i rari canali haversiani. Per questo, il primo tessuto osseo che si osserva in seguito al posizionamento di tali innesti si localizza sulla superficie di contatto tra l’ innesto stesso e il letto osseo ricevente. Qui, osteoclasti attivi provenienti dal letto ricevente inizieranno a demolire piccole porzioni dell’ innesto che saranno quindi riempite, per azione degli osteoblasti, da nuova componente minerale lamellare. Nel corso del tempo tutto l’ innesto sarà rimodellato ed entrerà a fare parte del normale turnover osseo.
©STEFANO PAGNUTTI
in Rinaldi, M. – Mottola, A. (a cura di):
Superamento degli ostacoli anatomici in chirurgia implantare.
Implantologia computer-guidata – Innesti ossei – ©ELSEVIER 2009







No Comments
Sorry, the comment form is closed at this time.